Uurimistöö "Kuhu kaob sool, kui see on vees lahustunud?" Leelismetallid ja nende ühendid Valge sool a lahustati vees
tekkis sade. Testaine lahuse teisele osale lisati baariumnitraadi lahust. Täheldati happes lahustumatu valge sademe moodustumist.
Teatavasti on selles ühendis sisalduv metallikatioon samuti osa klorofüllist ning metalli ennast kasutati varem fotograafias välklambi tootmiseks.
Määrake koostis ja kirjutage üles lähteaine nimi. Kirjutage üles kaks reaktsioonivõrrandit, mis viidi läbi tundmatu aine kvalitatiivse koostise määramise protsessis.
läikiv ja mittejuhtiv Õhus põletades tekkis valge kristalne aine, mis lahustub vees hästi. Saadud lahus jagati kaheks osaks ja lisati indikaatorid: fenoolftaleiini värvus ei muutunud, kuid violetne lakmus muutus punaseks. Millist ainet kasutas õpetaja näidiseksperimendis? Kirjutage üles kirjeldatud reaktsioonide võrrandid. VASTAVALT VÕRDIST NR 2 Arvutage toote mass, mis tekkis, kui reaktsiooni jaoks võeti 71 g valget, vees hästi lahustuvat kristalset ainet.
GIA-9-2011, C3 Tundmatu aine kvalitatiivse koostise kindlakstegemiseks anti koolilastele kompositsioonis sisalduva metalli soola.meteoriidid ja sellel on tugevad magnetilised omadused. Õpilased lahustasid selle soola pruunid kristallid vees, seejärel valati saadud kollakaspruun lahus kahte katseklaasi. Ühele neist lisati kaaliumhüdroksiidi lahust ja moodustus pruun sade. Teise valati hõbenitraadi lahus, mille tulemuseks oli valge juustune sade. Kirjutage üles tundmatu soola keemiline valem ja nimi. Kirjutage kaks molekulaarvõrrandit reaktsioonide jaoks, mis selle äratundmise käigus läbi viidi.
Tundmatu ebameeldiva lõhnaga värvitu gaasi kvalitatiivse koostise määramiseks absorbeeriti osa sellest baariumhüdroksiidi lahusega. Ma kukuksin välja, kui mäletanvalge sade, hapetes lahustuv. Teist osa kuumutati vesiniksulfiidiga. Sel juhul jälgis naine vees lahustumatu värvaine moodustumist. Kirjutage üles antud aine keemiline valem ja nimetus. Kirjutage kaks reaktsioonivõrrandit, mis viidi läbi selle omaduste uurimise käigus.
Ülesannete kataloog.
Ülesanne 22. Liht- ja kompleksainete keemilised omadused
Antud ained: , .
Kasutades vett ja vajalikke aineid ainult sellest loetelust, saate raud(II)hüdroksiidi kahes etapis. Kirjeldage toimuvate reaktsioonide märke. Ioonivahetusreaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Antud ained: . Mangaan(II)hüdroksiid saadakse kahes etapis, kasutades vett ja vajalikke aineid ainult sellest loetelust. Kirjeldage toimuvate reaktsioonide märke. Ioonivahetusreaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: Kasutades vett ja vajalikke aineid ainult sellest loetelust, saadakse metalliline vask kahes etapis. Kirjeldage toimuvate reaktsioonide märke. Ioonivahetusreaktsiooni jaoks kirjutage lühendatud ioonvõrrand
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Antud ained:
Kasutades vett ja vajalikke aineid ainult sellest loendist, saate broomi kahes etapis ilma elektrivoolu kasutamata. Kirjeldage jätkuvate reaktsioonide märke. Ioonivahetuse reaktsiooni kohta pi-shi-ga on reaktsiooni lühendatud ioonivõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Antud ained:
Kasutage vask(II)kloriidi kahes etapis, kasutades ainult selle loendi vett ja mittekuume aineid. Kirjeldage minu reaktsioonide märke. Teise reaktsiooni jaoks on siin lühendatud ioonireaktsiooni võrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: Kasutades vett ja vajalikke aineid ainult sellest loetelust, saadakse raud(II)hüdroksiid kahes etapis. Kirjeldage toimuvate reaktsioonide märke. Ioonivahetusreaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Antud ained: Vask(II)hüdroksiid saadakse kahes etapis, kasutades vett ja ainult selles loendis olevaid vajalikke aineid. Kirjeldage toimuvate reaktsioonide märke. Ioonivahetusreaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: Kasutades vett ja vajalikke aineid ainult sellest loetelust, saadakse vask(II)hüdroksiid kahes etapis. Kirjeldage toimuvate reaktsioonide märke. Ioonivahetusreaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Katse jaoks pakuti välja järgmised reaktiivid: vesinikkloriidhape, naatriumhüdroksiidi, naatriumnitraadi, baariumnitraadi, raud(II)sulfaadi lahused. Kasutades ainult selles loendis olevaid vajalikke aineid, saadakse kahe järjestikuse reaktsiooni tulemusena raud(II)hüdroksiid.
Kirjeldage toimuvate reaktsioonide märke. Teise reaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Katse jaoks pakuti välja järgmised reaktiivid: tsink (granuleeritud), vask(II)oksiid, ammoniaagilahus, tsinksulfaadi lahus, vesinikkloriidhape. Kasutades ainult selles loendis olevaid vajalikke aineid, saadakse kahe järjestikuse reaktsiooni tulemusena tsinkoksiid.
Kirjeldage toimuvate reaktsioonide märke. Esimese reaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Katse jaoks on välja pakutud järgmised reaktiivid:
lahendused:
Kasutades vett ja vajalikke aineid ainult sellest loendist, saate kaltsiumnitraati kahes etapis. Kirjeldage toimuvate reaktsioonide märke.
Teise reaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Antud ained:. Vask(II)nitraat saadakse kahes etapis, kasutades vett ja vajalikke aineid ainult sellest loetelust. Kirjeldage toimuvate reaktsioonide märke. Teise reaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Katse jaoks on välja pakutud järgmised reaktiivid: lahused Kasutades ainult sellest loendist vajalikke aineid, saadakse kahe järjestikuse reaktsiooni tulemusena raud(II)nitraadi lahus. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Teise reaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: Kasutades vett ja vajalikke aineid ainult sellest loetelust, saadakse raud(II)hüdroksiid kahes etapis. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Ioonivahetusreaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ex-peri-men-ta ennetamiseks on soovitatav kasutada järgmisi re-ak-ti-you: kaaliumnit-ra-ta, hüdro-rock-si-da kaaliumi, sul- fa-ta magnium, kloor-ri-da baarium ja kloor-ri-da na-trium. Kasutades ainult selle loendi sobimatuid aineid, re-zul-ta-te pro-ve-de-tionis kaks järgnevat kaaliumkloriidi lahuse reaktsiooni.
Koostage teisenduste skeem, mille tulemusena saate määratud aine. Kirjutage üles kahe reaktsiooni võrrand. Esimese reaktsiooni jaoks looge lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Katse jaoks pakuti välja järgmised reaktiivid: alumiinium ja ammoniaagi, baariumkloriidi, vesinikperoksiidi, alumiiniumsulfaadi, vesinikkloriidhappe lahused. Kasutades ainult selles loendis olevaid vajalikke aineid, saadakse kahe järjestikuse reaktsiooni tulemusena alumiiniumkloriidi lahus.
Koostage teisenduste skeem, mille tulemusena saate näidatud aine. Kirjutage üles kahe reaktsiooni võrrandid. Teise reaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: Kasutades vett ja vajalikke aineid ainult sellest loetelust, saadakse raud(III)hüdroksiid kahes etapis. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Ioonivahetusreaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Katse jaoks pakuti järgmisi reaktiive: fenoolftaleiini lahused. Kasutades ainult selles loendis olevaid vajalikke aineid, saadakse kahe järjestikuse reaktsiooni tulemusena naatriumkloriidi lahus. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Teise reaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: Kasutades vett ja vajalikke aineid ainult sellest loetelust, saadakse magneesiumnitraat kahes etapis. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Teise reaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: lahused ja ammoniaak. Kasutades vett ja vajalikke aineid ainult sellest loendist, saate ammooniumkloriidi lahuse kahes etapis. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Teise reaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: lahus Kasutades vett ja vajalikke aineid ainult sellest loetelust, valmistage tsinkkloriidi lahus kahes etapis. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Teise reaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on toodud: Kasutades vett ja vajalikke aineid ainult sellest loetelust, saate kaltsiumvesinikkarbonaadi kahes etapis. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Esimese reaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Katse jaoks on välja pakutud järgmised reaktiivid: lahused: Hõbekloriid saadakse kahes etapis, kasutades vett ja ainult selles loendis olevaid vajalikke aineid. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Teise reaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: lahus ja ammoniaagilahus. Kasutage raud(III)oksiidi kahes etapis, kasutades ainult sellest loendist vett ja vajalikke aineid. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Ioonivahetusreaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: Kasutades vett ja vajalikke aineid ainult sellest loetelust, saadakse tsinknitraat kahes etapis. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Ioonivahetusreaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Katse jaoks on välja pakutud järgmised reaktiivid: lahused. Kasutades vett ja ainult sellest loendist vajalikke aineid, saadakse raud(III)hüdroksiid kahes etapis. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Ioonivahetusreaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Antud ained: Kasutage vask(II)kloriidi kahes etapis, kasutades vett ja ainult selles loendis olevaid vajalikke aineid. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Teise reaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Antud ained: lakmuslahus. Kasutades vett ja vajalikke aineid ainult sellest loendist, saadakse kahe järjestikuse reaktsiooni tulemusena ammooniumnitraadi lahus. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Teise reaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: lahus Kasutades vett ja vajalikke aineid ainult sellest loetelust, saadakse kahes etapis raud(II)kloriidi lahus. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Ioonivahetusreaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Katse jaoks pakuti välja järgmised reaktiivid: naatriumkloriidi, naatriumhüdroksiidi, väävelhappe, baariumkloriidi, metallilise raua lahused. Kasutades ainult selles loendis olevaid vajalikke aineid, saadakse kahe järjestikuse reaktsiooni tulemusena raud(II)kloriidi lahus.
Koostage diagramm transformatsioonidest, mille tulemusena saab näidatud ainet. Kirjutage üles kahe reaktsiooni võrrandid. Teise reaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Ained on antud: Kasutades vett ja vajalikke aineid ainult sellest loetelust, saadakse tsinksulfiid kahes etapis. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Ioonivahetusreaktsiooni jaoks kirjutage reaktsiooni lühendatud ioonvõrrand.
Salvestatud
Sisestage ülalolevale väljale ülesande vastus või laadige see üles (vormingus .txt, .doc, .docx, .pdf, .jpg, .png):
Katse jaoks on välja pakutud järgmised reaktiivid: lahused. Kasutades vett ja ainult sellest loendist vajalikke aineid, saadakse tsinkhüdroksiid kahes etapis. Kirjutage üles läbiviidud keemiliste reaktsioonide võrrandid. Kirjeldage nende reaktsioonide tunnuseid. Teise reaktsiooni jaoks kirjutage lühendatud ioonvõrrand.
Oh soola mia!
Me ei eksinud mainides kuulsat itaalia laulu “Minu päike!”: paljudel maailma rahvastel on “sool” ja “päike” sama tüvisõna "elusool" jõudis meieni.
Sool sümboliseeris rikkust ja võimu, kaitstuna kurjade jõudude eest: iidsed valitsejad istusid sageli soolast valmistatud troonil. Nendest kaugetest aegadest on jäänud palju traditsioone. Venelased tervitavad kõrgeid külalisi leiva ja soolaga. Hingamispäeva tähistavad juudid murravad pärast käte pesemist leiva ja kastavad selle soolatopsi, jagades selle kogu perele. Harjumusest on paljude rahvaste laual soolatops tänini, sest varem valmistati toitu ilma soolata, aga soolatati laual. Ja igavat, ebahuvitavat elu või inimest nimetatakse endiselt sõnaks "hapnemata", millel on "soolane" vastupidine tähendus.
Kas me teame soolast kõike?
Sool ehk naatriumkloriid on looduses leiduv valge kristalne mineraalaine; lahustub vees; üks väheseid mineraale, mida inimesed söövad. Sool on vürtsidest vanim.
Palju sajandeid oli sool väärtuslik kaup. Sõdu peeti soola pärast, moodustati ja hävitati riike. Rooma impeeriumi lõpul ja kogu keskajal oli sool väärtuslik kaup, mida veeti mööda "Soolateid" germaani hõimude südamikku. Linnad, osariigid ja vürstiriigid, mille kaudu "soolatee" läbis, kehtestasid kaupmeestele tohutud maksud soola transportimise eest läbi nende territooriumi. See tähistas sõdade algust ja põhjustas isegi mõne linna asutamise, näiteks Müncheni aastal 1158.
Keegi ei vaidle vastu sellele, et sool on esmavajalik.
Inimkehas on seda 300 g.
Iga päev kulub see varu ära ja iga päev tuleb seda täiendada.
Ärge arvake, et sool on vajalik ainult toidu maitse jaoks. See toimib materjalina, millest maos moodustub vesinikkloriidhape.
Tänu sellele happele seeditakse toit ja mikroobid surevad. Lisaks säästab sool meid dehüdratsioonist, säilitades kehas niiskust.
Nüüd on sool laialt saadaval ja me ei väärtusta seda, kuid see ei olnud alati nii. Vanasti puhkesid soola pärast tõelised sõjad, sellega maksti makse ja talupoegade mässud kustutati soola jagamisega.
Hiinas teeniti isegi soolast raha. Selleks keedeti soolvett paksuks, kuni see võttis taigna kuju. Seejärel valmistasid nad sellest "taignast" pirukaid, panid neile keisri märgi ja kuivatasid.
Sool on avaldanud suurt mõju erinevatele keeltele. Suurim mõju avaldati keeltele, mis suhtlesid Rooma ja Kreeka tsivilisatsioonidega, samal ajal kui sool oli kõrgel tasemel.
Rooma sõduritele anti luba osta soola (ladina keeles: sal), salarium argentum, millest tuleneb ingliskeelne sõna salary. Roomlased eelistasid ka oma rohelisi soolata, mille tulemusena sai ladinakeelsest sõnast soola osa uuest sõnast salat. Barbari ladina keeles tähendas salata "soolast".
Riikides, kus puudusid soolamaardlad, kaevandati seda mingil keerulisel viisil. Näiteks Miklouho-Maclay kirjutas, et paapualased kogusid pikalt merevees lebanud puutükke, põletasid need ära ja sõid ära soolatud tuha.
Soola saadakse kahel viisil: kaevandamine ja merevee aurustamine.
Erinevat tüüpi soolade keemiline koostis on sama – 99% naatriumkloriidi –, kuid kristallstruktuur on väga erinev. Tavaline lauasool koosneb väikestest graanulitest, on palju ebaühtlasema struktuuriga ja suurem. Popkornis kasutatakse kergesti lahustuvat soola. Kivisool on suured tükid mineraalsest naatriumkloriidist. Kuju ja struktuuri erinevus võimaldab erinevaid maitseid ja on kasulik erinevate roogade jaoks. Väga oluline on ka selle lahustumiskiirus ning marineerimissool peab olema väga peen, et lahustuda ka külmas vedelikus.
Meresoola, mis on valmistatud mereveest, on samuti erinevaid sorte. Tänu vees leiduvatele ainetele on meresool ainulaadne maitse, mida kasutatakse paljudes köökides.
KIVIsool. See tüüp on ilmselt kõige populaarsem ja laialt levinud. Tahkeid soolaladestusi leidub paljudes maailma piirkondades, kus need asuvad mitmesajast kuni enam kui tuhande meetri sügavusel. Spetsiaalsed kombainid hakivad soola maa all ja see transporditakse konveierite kaudu maapinnale.
Seal läheb see veskidesse ja mureneb, et tekitada erineva suurusega osakesi (kristalle). Jämedamat soola kasutatakse peamiselt tööstuslikul otstarbel, peenemat soola aga toiduks. Kivisoola eristab madalaim võõrlisandite sisaldus, madal õhuniiskus ja kõrgeim naatriumkloriidi sisaldus - kuni 99%. See tähendab, et see on rohkem küllastunud kui teised.
SETTE SOOL moodustub soola loomulikul aurustumisel veekogudes. Geograafiatundidest meenuvad kõigile kuulsad Astrahani piirkonna soolajärved Elton ja Baskunchak.
Spetsiaalsed kombainid (kombainid) eemaldavad kuivanud järvedelt soolakihi ja saadavad selle mööda konveierit purustamiseks, pesemiseks, kuivatamiseks ja edasiseks töötlemiseks. Aiasool sisaldab rohkem lisandeid (savi, liiv) ja naatriumkloriidi massiosa võib olla 95-96% (selle tõttu on see sageli hallikas).
VAKUUMAURUSTI SOOL. Kui sool asub väga sügaval, ekstraheeritakse see lahustamise teel. Soolakihti asetatakse toru ja sinna pumbatakse kõrge rõhu all magedat vett, mis lahustab soola, moodustades ladestusse õõnsused. Seejärel tõstetakse kontsentreeritud soolvesi torude kaudu pinnale, kus seda töödeldakse ja vaakumis aurustatakse vaakumis, et saada kõrge puhtusega toode.
Mõnikord aurustatakse pinnale tõstetud soolvesi avatud anumates päikese all. Sool ladestustes on sageli väga puhas ja vajab vaid väikest täiendavat puhastamist.
Aurustussool on kõige kallim ja samas keemiliselt puhtaim ja kvaliteetsem. Meie riigis müüakse seda kaubamärgi "Extra" all.
Aurustumine on samuti rikas naatriumi poolest. Seetõttu peaks perenaine pöörama tähelepanu sellele, millist soola ta kasutab, ja siit arvutama selle kogust.
Kuna sool on toode, mida sööme iga päev ligikaudu samades kogustes, kasutatakse seda üha enam mikroelementide kandjana. Sool on rikastatud peamiselt joodi ja fluoriga.
Näiteks 60% Saksamaal ja 80% Šveitsis müüdavast soolast on rikastatud fluoriidiga. Seda soola kasutatakse hambahaiguste ennetamiseks. Nõus, et hambapasta mõju on palju väiksem, selle mõju on lokaalne ja väga lühiajaline.
Riikides, kus esineb joodipuudust, toodetakse joodiga rikastatud soola. Meie kehas laguneb selline sool kiiresti ja vabastab joodi, mis on vajalik kilpnäärmele kilpnäärmehormoonide sünteesiks. Sellise soola tarbimine koguses 5-6 g päevas rahuldab organismi joodivajaduse täielikult.
Tänapäeval on joodipuuduse probleem väga terav. Esiteks seetõttu, et see mõjutab tohutult inimesi ning selle võimalikke tagajärgi üksikisikutele ja ühiskonnale. Näiteks Venemaal on joodipuudusele vastuvõtlikud 98 miljonit inimest, kellest enam kui pooled on lapsed, noorukid ja rasedad naised.
Joodi puudus toidus toob kaasa pöördumatud muutused närvisüsteemis. Kesknärvisüsteemi kahjustuste tõttu tekib vähese jooditarbimisega piirkondade lastel vaimne alaareng – üks raskemaid joodipuuduse ilminguid.
Sool on meie peamine maitseaine ja see on inimesele vajalik, kuna selle loomulikust kogusest vees ja toidus meie kehale ei piisa.
Ärge unustage, et inimese vajadus lauasoola järele sõltub energiatarbimisest, kliimatingimustest jne. Intensiivse kehalise aktiivsusega kaotab inimene soolast kuni 20 grammi päevas, seega on parasvöötmes soola tarbimine 10-15 grammi. päeva kohta.
Pange tähele, et soola ebapiisav või puudumine halvendab toidu maitset. Kui inimene ei saa pikka aega lauasoola, võib see põhjustada pearinglust, minestamist, nõrkust ja muid valusaid nähtusi. Liigne sool pole vähem kahjulik.
Veenduge, et soola maitse oleks puhtalt soolane, ilma võõra maitse ja lõhnata. Soola (ekstra) värvus on puhas valge. Teiste sortide puhul on lubatud toonid: hallikas, kollakas ja roosakas. Ei tohiks olla nähtavat saastumist.
Säilitage soola kuivas, suhteliselt kõrge õhuniiskusega kohas. Madalama õhuniiskuse korral eraldab see niiskust väliskeskkonda, s.t. kuivab ja kõrgemal tasemel niisutab. Sool on võimeline paakuma ja kaotab voolavuse, kusjuures peensool on tugevam ja jäme sool nõrgem. Toorsoola koogid rohkem kui kuivsool.
Kaaliumjodiidi sisaldav jodeeritud sool oksüdeerub niiskuse, õhu ja valguse juuresolekul, vabastades joodi, mis seejärel aurustub. Lauasoolas ja õhus on alati niiskust, mis soodustab kaaliumjodiidi lagunemist. Jodeeritud soola säilitamisel väheneb joodisisaldus järk-järgult. Seda tuleks hoida kuivas kohas suletud anumas. Kuue kuu pärast peetakse seda normaalseks toiduks.
Teadaolevad hoiused
* Artjomovski väli on Euroopa suurim. Kaevandamine Artemsoli riikliku tootmisühingu kaevanduses.
* Baskunchaki maardla, JSC Bassoli tootmine järvest. Baskunchaki raudtee ehitati soola eksportimiseks.
* Iletski maardla, tootmine JSC Iletsksoli kaevanduses
* Odessa jõesuudmed (kaevandamine toimus 1774-1931)
* Eltoni väli Elton
Huvitavaid fakte
* Tavaline lauasool võib olla kange mürk. Ühest küljest ei saa ilma soolata elada, teisalt on tavapärasest 10 korda suurem annus surmav. Surmav annus on 3000 milligrammi 1 kilogrammi kehakaalu kohta. Ehk siis 80 kg kaaluva inimese puhul tuleb kasutada veerandkilost pakki.
* Külma kliimaga riikides on organismi poolt nõutav päevanorm oluliselt madalam kui kuuma kliimaga maades, seda erinevat tüüpi higistamise tõttu. Täiskasvanu keskmine päevane kogus: külmades riikides 3-5 grammi soola ja kuumades maades kuni 20 grammi.
* Kauplustes koosneb sool kuni 97% NaCl-st, ülejäänu tuleb erinevatest lisanditest. Kõige sagedamini lisatakse viimastel aastatel jodaate ja karbonaate, üha sagedamini on lisatud fluoriide. Hambahaiguste ennetamiseks kasutage soola fluoriidiga. Alates 1950. aastatest on Šveitsis soolale lisatud fluori ning tänu positiivsetele tulemustele võitluses hambakaariesega hakati 1980. aastatel soolale lisama fluori Prantsusmaal ja Saksamaal. Kuni 60% Saksamaal ja kuni 80% Šveitsis müüdavast soolast on fluorisool.
* Süstemaatiline liigse soola tarbimine võrreldes füsioloogilise normiga toob kaasa vererõhu tõusu. Liigne soolatarbimine põhjustab südame- ja neeruhaigusi.
* Venemaal toimus 17. sajandil soolamäss, mille põhjustasid üüratult kõrged soolahinnad.
Nižni Novgorodi oblasti Ardatovski munitsipaalrajooni administratsiooni haridusosakond
Munitsipaalharidusasutus
"Ardatovskaja 1. keskkool"
Uurimistööde ja -projektide konkurss eelkooliealistele ja algkooliealistele lastele “Mina olen teadlane”
Nominent: Ökoloogiline ja bioloogiline tegevus
„Kuhu sool kaob?
kui lahustatakse
ta vees?
Olen töö ära teinud:
Plotov Gleb Jurjevitš - 8-aastane,
2. klassi õpilane
Juhendaja:
Makurina Marina Nikolaevna,
algkooli õpetaja
p.g.t. Ardatov
2008
Juhataja seletuskiri.
Olen olnud algklasside õpetaja üle 20 aasta. Ja algklassilapsed on väga uudishimulikud, nad on huvitatud kõike teadma. Miks on Maa ümmargune? Kus jõed voolavad? Miks sajab lund? Kuhu suhkur kaob, kui see visatakse kuuma tee sisse? Miks on sidrun hapu ja banaan magus? Kõigile neile ja teistele sarnastele küsimustele peab õpetaja vastama. Mis siis, kui lapsed ise leiavad oma küsimustele vastused? Otsustasin teha väikese eksperimendi - kutsusin kõige uudishimulikuma õpilase uurima küsimust "Kuhu läheb sool, kui see vees lahustub?" Ja nii, mine edasi, soola otsima!
Sissejuhatus……………………………………………………………………….4 lk.
Uurimismetoodika ja tehnoloogia……………………………………..6 lk.
Uuringu tulemused ja nende arutelu……………………………7 lk.
Järeldused…………………………………………………………………8 lk.
Kasutatud kirjanduse loetelu…………………………………….9 lk.
Lisa………………………………………………………… 10 lehekülge.
1. Sissejuhatus.
Ma käin teises klassis, olen õppinud palju vajalikku ja huvitavat, kuid tahan veel palju teada! Armastan lugeda harivaid raamatuid ja saan neist palju huvitavat teada. Ja ühel päeval palus ema mul pastavett soolata. Viskasin kaussi väikese lusikatäie soola, siis segasin ja nägin, et sool oli kadunud. Kuhu ta läks? See muutus minu jaoks huvitavaks. Järgmisel päeval küsisin selle kohta oma õpetajalt ja ta soovitas mul uurimistöö ise läbi viia, loomulikult tema abiga. Kuid kõigepealt otsustasin uurida kõike soola kohta, mis see on, kust see tuleb.
Minu uurimistöö eesmärk
– uurige, kuhu sool vees lahustades läheb.
Ülesanded:
- õppida, mis on sool ja kust seda kaevandatakse
-viima läbi katseid soola lahustamiseks vees ja soola aurustamiseks soolalahusest.
-tean oma uurimistöö tulemuste põhjal järeldused
«Sool on kristalne aine, mis lahustub vees hästi. Seda leidub palju meredes, kust see pärineb lisajõgedest. Jõevesi omakorda neelab selle pinnasest, millest see läbi voolab.
Sool või naatriumkloriid. - eluks ülimalt oluline aine. Ka inimkeha sisaldab üsna palju soola. Seda leidub ka looduslikes toiduainetes. Kuid meile meeldib see nii väga, et lisame seda alati oma toidule. Sool, mida sööme, pärineb enamasti mereveest. Üks liiter seda sisaldab 30-40 grammi soola. . (“Kõik kõigest” Populaarne lasteentsüklopeedia. 8. köide / G. Šalaeva 1994, lk 280-281.)
«Soola saadakse soolakaevandustest, allikatest, soolajärvedest ja merest.
Soolakaevandustes sädelevad tunnelid ja koridorid nagu jääst. Kaevurid lõikasid välja plokid, mis seejärel purustatakse tükkideks, laaditakse kärudesse ja transporditakse spetsiaalsete rongidega trepist üles. Mõnel pool ammutatakse soola spetsiaalsete soolakaevude kaudu. Tavaliselt puuritakse kaevud vee ammutamiseks. Vastupidi, soolakaevudesse valatakse kuum vesi. Vesi levib maa all ja lahustab soola. Maa alla moodustub soolvesi. Seejärel pumbatakse soolvesi välja ja kuumutatakse tohututes mahutites. Seal vesi aurustub ja sool settib põhja.
Mõnikord läbivad maa-alust kivisoolamaardlate jõge maa-alused jõed. Siis lahustab vesi soola ja maa alla moodustuvad soolakoopad.
Suurimad soolakoopad asuvad Tšehhis Velichka küla lähedal.
Soola kaevandatakse ka muul viisil. Mere kaldale on ehitatud spetsiaalsed madalad basseinid – soolapressid. Merevesi valatakse neisse spetsiaalse kanali kaudu.
Kuum päike soojendab vett ja see aurustub kiiresti ning selle toodud sool jääb basseini.
Iidsetel aegadel toodi soola Euroopasse kaugelt. Seda kaevandati peamiselt rannikualadel ja mõnel soolajärvel.
Seetõttu hinnati soola koos väärismetallidega kõrgelt. Kohati kasutati soola isegi rahaasendajana.
Venemaal on kaks sellist järve - Elton ja Baskunchak. Nende kallastel on soola kaevandatud iidsetest aegadest peale.
Sool mängib inimese elus tohutut rolli, seda ei tarbita ainult toiduna. Varem oli see põhiaine toiduainete riknemise eest kaitsmiseks. (“Kõik kõigest” Populaarne lasteentsüklopeedia. köide 11. / G. Šalaeva 1999 lk 277-278)
2. Uurimistöö metoodika ja tehnoloogia.
Katse nr 1 Soola lahustamine vees.
Võtke kraanist tavalist vett ja maitsestage. (foto 1)
Seejärel maitsetakse samamoodi soola. (foto 2)
Seejärel maitsestatakse vett sellesse segatud soolaga. (foto 5)
Soollahus valatakse alumiiniumpannile ja pannakse tulele. (foto 6)
Lahenduse oleku jälgimine. (foto 7)
Määrake saadud valge katte maitse - "kärbsed". (foto 8,9)
Uurige lauasoola suurendusklaasi all. (foto10)
Uurige suurendusklaasi all pärast vee aurustumist pannile tekkinud valget katet. (foto 11)
3. Uurimistulemused ja nende arutelu.
Kogemus nr 1. Soola lahustamine vees.
Vesi ei maitse.
Sool on soolase maitsega.
Pärast segamist pole vees soola näha.
Vesi muutus soolaseks.
Kogemus nr 2. Soola aurustamine soolvee lahusest.
Pärast keetmist hakkab vesi järk-järgult aurustuma ja kadus seejärel täielikult.
Panni seintele ja põhjale ilmusid valged “kärbsed”.
"Kärbsed" maitsevad soolaselt.
Kogemus nr 3. Lauasoola ja "kärbeste" võrdlus
Soola esindab sooda läbipaistvate veerisena - erineva kuju ja mahuga kristallidena.
"Kärbsed" on valget värvi ja palju väiksemad kui soolakristallid, sarnaselt pulbriga.
4. Järeldused.
1. järeldus. – Kui segate vette soola, muutub vesi soolaseks. Kuid soola ennast vees näha ei ole. Sellest kõigest järeldub, et sool lahustus vees.
2. järeldus – Kui niiskus soolalahusest aurustub, jääb sool panni seintele ja põhja, muutudes valgeks pulbriks – “kärbeseks”.
3. järeldus – Vees lahustuv sool laguneb väikesteks osakesteks.
Üldine järeldus - See tähendab, et sool ei kao veest. Lihtsalt soolakristallid lagunevad vette sattudes nii väikesteks osakesteks, et neid pole näha. Kuid samal ajal on need olemas, kuna pärast vee aurustumist jääb nendest nähtamatutest osakestest moodustunud valge kate, millel on soolane maitse. Ja võime öelda, et soolaosakesed ja veeosakesed on sõbrad. Nad sirutavad oma käed üksteisele, ühinedes kindla käepigistusega - soolalahusega.
Kasutatud kirjanduse loetelu.
Kõik kõige kohta. Populaarne entsüklopeedia lastele. 8. köide. Koostanud: G. Šalaeva. Filoloogiaühing "Slovo" AST. Moskva Riikliku Ülikooli ajakirjandusteaduskonna humanitaarteaduste keskus. M.V.Lomonosov., M., 1994
Kõik kõige kohta. Populaarne entsüklopeedia lastele. 11. köide. Koostanud: G. Šalaeva. Filoloogiaühing "Slovo" AST. Moskva Riikliku Ülikooli ajakirjandusteaduskonna humanitaarteaduste keskus. M.V.Lomonosova, M., 19 99
6. Taotlus.
Foto 1.Võtke kraanist puhast vett ja maitsestage

2. foto. Seejärel maitsetakse samamoodi soola.



5. foto. Seejärel maitsestatakse vett sellesse segatud soolaga.

6. foto. Soollahus valatakse alumiiniumpannile ja pannakse tulele.

Foto 7. Lahenduse oleku jälgimine.


Fotod 8 ja 9. Määrake saadud valge katte maitse - "kärbsed".

10. foto. Uurige lauasoola suurendusklaasi all.

Foto 11. Uurige suurendusklaasi all pärast vee aurustumist pannile tekkinud valget katet.
Viimased saidi materjalid
Video

Kuidas tõukemärguandeid lubada ja keelata?
Apple vastutab iOS-i push-teatiste õige toimimise eest. Kõik kolmanda osapoole rakendused, mis soovivad kasutajale teateid saata, peavad selleks kasutama Apple'i servereid. Skeem näeb välja selline: arendaja tõstab oma seri
Video

Android-telefoni teemade allalaadimine Parimad teemad teie telefoni jaoks
Tahtsin postitada mobiiltelefoni taustapilte - arvan, et ei tasu rääkida sellest, et need näevad suurepärased välja ainult pealkirjas märgitud eraldusvõimega, muul juhul on need välja veninud või vastupidi, mitte kogu ekraan. Pildid
Sotsiaalmeedia

Yandexi brauser käivitub pidevalt: kuidas käivitamist tühistada, käivitada brauser ilma täiendava aknata
Yandex on populaarne brauser, mis rõõmustab oma fänne kõrge funktsionaalsusega. Programmi hoolikas uurimine võimaldab meil märkida selle töö stabiilsust ja usaldusväärsust, kasutajasõbralikku liidest ja mis tahes lehtede kiiret laadimist. Vaatamata sellele, sisse
Video
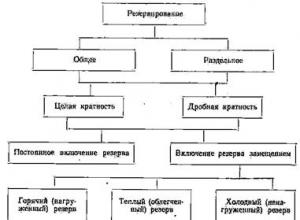
Broneerimine: üldine ja eraldi
Liiasusmeetodite klassifikatsioon ULDUSVÄÄRSUSE SUURENDAMINE RESERVEERIMINE KUI MEETOD Redundantsus on üks peamisi vahendeid objekti etteantud töökindluse (eriti tõrkevaba töö) taseme tagamiseks, kui elemendid ei ole piisavalt töökindlad. Reservid
Brauserid

Mis on tähis Kuidas tehakse märki
Mis on VKontakte signa, vaatame seda küsimust täna. Kuni selle artikli kirjutamise hetkeni kuulsin kuskil sõna signa, kuid ma isegi ei mõelnud, mis on signa ja miks neid VKontakte'is tehakse. Sotsiaalvõrgustikus VKontakte on palju veidrusi ja signaale nagu lk
Arvuti

Samsung Galaxy Note9 nutitelefoni ülevaade: peaaegu veatu
Galaxy Note'i perekonnal on teiste Samsungi nutitelefonide seas eriline koht. Lõppude lõpuks on just selle sarja mudelid alati seadnud kvaliteedi ja tehniliste võimaluste traditsiooni. Seeria igas uues nutitelefonis tutvustas Lõuna-Korea kaubamärk uusi tehnoloogiaid,